Các công nghệ sản xuất axit sulfuric H2SO4
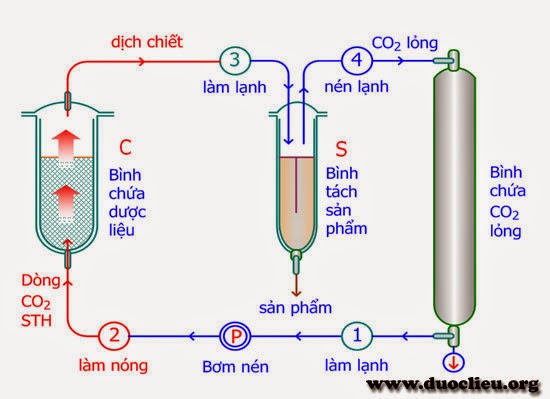
CÁC CÔNG NGHỆ SẢN XUẤT AXIT SULFURIC H2SO4 Có ba công nghệ sản xuất axit sulfuric là công nghệ tiếp xúc, công nghệ NOx và công nghệ CaSO4. Nguyên lý chung của các công nghệ này đều là thu SO2 từ các nguyên liệu đầu vào khác nhau như lưu huỳnh, pyrit, chalkopyrit, sphalerit, galenit, CaSO4, các […]
Xem thêm